Boltsman sabitinin ölçüsü. Ludwig Boltzmann: Şəxsi nailiyyətlər
Boltzman sabiti (k (\displaystyle k) və ya k B (\displaystyle k_(\rm (B)))) - temperatur və enerji arasındakı əlaqəni təyin edən fiziki sabit. Bu sabitin əsas rol oynadığı statistik fizikaya böyük töhfələr verən avstriyalı fizik Lüdviq Boltzmanın adını daşıyır. Əsas SI vahidlərinin təriflərindəki dəyişikliklərə görə SI Beynəlxalq Vahidlər Sistemində onun dəyəri (2018) tam olaraq bərabərdir.
k = 1,380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\dəfə 10^(-23)) J/.Temperatur və enerji arasındakı əlaqə
Mütləq temperaturda homojen ideal qazda T (\displaystyle T), Maksvell paylanmasından aşağıdakı kimi hər bir tərcümə sərbəstlik dərəcəsi üçün enerji bərabərdir, k T / 2 (\displaystyle kT/2). Otaq temperaturunda (300 ) bu enerjidir 2 , 07 × 10 − 21 (\displaystyle 2(,)07\dəfə 10^(-21)) J və ya 0,013 eV. Monatomik ideal qazda hər bir atom üç fəza oxuna uyğun gələn üç sərbəstlik dərəcəsinə malikdir, yəni hər atomun enerjisi 3 2 k T (\displaystyle (\frac (3)(2))kT).
İstilik enerjisini bilməklə, atom kütləsinin kvadrat kökü ilə tərs mütənasib olan atomların orta kvadrat sürətini hesablaya bilərik. Otaq temperaturunda orta kvadrat sürət helium üçün 1370 m/s-dən ksenon üçün 240 m/s arasında dəyişir. Molekulyar qaz vəziyyətində vəziyyət daha da mürəkkəbləşir, məsələn, iki atomlu qaz 5 sərbəstlik dərəcəsinə malikdir - 3 translyasiya və 2 fırlanma (aşağı temperaturda, molekuldakı atomların titrəmələri həyəcanlanmadıqda və əlavə azadlıq əlavə edilmir).
Entropiyanın tərifi
Termodinamik sistemin entropiyası müxtəlif mikrovəziyyətlərin sayının təbii loqarifmi kimi müəyyən edilir. Z (\displaystyle Z), verilmiş makroskopik vəziyyətə uyğundur (məsələn, verilmiş ümumi enerjiyə malik vəziyyət).
S = k ln Z . (\displaystyle S=k\ln Z.)Proporsionallıq faktoru k (\displaystyle k) və Boltsman sabitidir. Bu, mikroskopik ( Z (\displaystyle Z)) və makroskopik vəziyyətlər ( S (\displaystyle S)), statistik mexanikanın mərkəzi fikrini ifadə edir.
Temperatur və enerji arasında müəyyən əlaqə. Bu sabitin əsas rol oynadığı statistik fizikaya böyük töhfələr verən avstriyalı fizik Lüdviq Boltzmanın adını daşıyır. Beynəlxalq Vahidlər Sistemində (SI) onun eksperimental dəyəri:
J/.Mötərizədə olan rəqəmlər kəmiyyət dəyərinin son rəqəmlərindəki standart xətanı göstərir. Boltzman sabitini mütləq temperaturun və digər fiziki sabitlərin tərifindən əldə etmək olar. Bununla belə, birinci prinsiplərdən istifadə edərək Boltsman sabitinin hesablanması çox mürəkkəbdir və mövcud bilik vəziyyəti ilə mümkün deyil. Plank vahidlərinin təbii sistemində temperaturun təbii vahidi Boltsman sabitinin vahidə bərabər olması üçün verilir.
Temperatur və enerji arasındakı əlaqə
Mütləq temperaturda homojen ideal qazda, hər bir translyasiya sərbəstliyi üçün enerji Maksvell paylanmasından aşağıdakı kimidir. Otaq temperaturunda (300°C) bu enerji J və ya 0,013 eV-dir. Monatomik ideal qazda hər bir atom üç fəza oxa uyğun gələn üç sərbəstlik dərəcəsinə malikdir, yəni hər bir atomun enerjisi .
İstilik enerjisini bilməklə, atom kütləsinin kvadrat kökü ilə tərs mütənasib olan atomların orta kvadrat sürətini hesablaya bilərik. Otaq temperaturunda orta kvadrat sürət helium üçün 1370 m/s-dən ksenon üçün 240 m/s arasında dəyişir. Molekulyar qaz vəziyyətində vəziyyət daha da mürəkkəbləşir, məsələn, iki atomlu qaz təxminən beş sərbəstlik dərəcəsinə malikdir.
Entropiyanın tərifi
Termodinamik sistemin entropiyası verilmiş makroskopik vəziyyətə (məsələn, verilmiş ümumi enerjiyə malik vəziyyətə) uyğun gələn fərqli mikrovəziyyətlərin sayının təbii loqarifmi kimi müəyyən edilir.
Mütənasiblik əmsalı Boltsman sabitidir. Mikroskopik () və makroskopik vəziyyətlər () arasındakı əlaqəni təyin edən bu ifadə statistik mexanikanın mərkəzi fikrini ifadə edir.
həmçinin bax
Qeydlər
Wikimedia Fondu. 2010.
Digər lüğətlərdə "Boltzmann sabitinin" nə olduğuna baxın:
- (simvol k), universal QAZ sabitinin AVOQADRO SAYISINA nisbəti, Kelvin dərəcəsi üçün 1,381,10 23 joula bərabərdir. O, qaz hissəciyinin (atom və ya molekulun) kinetik enerjisi ilə onun mütləq temperaturu arasındakı əlaqəni göstərir.... Elmi-texniki ensiklopedik lüğət
Boltzman sabiti- - [A.S.Qoldberq. İngilis-Rus enerji lüğəti. 2006] Ümumi enerji mövzuları EN Boltzmann daimi ... Texniki Tərcüməçi Bələdçisi
Boltsman sabiti- Boltzmann Constant Boltzmann Constant Temperatur və enerji arasındakı əlaqəni təyin edən fiziki sabit. Statistik fizikaya böyük töhfələr verən Avstriyalı fizik Lüdviq Boltzmanın şərəfinə adlandırılmışdır ki, bu daimi ... Nanotexnologiya üzrə ingiliscə-rusca izahlı lüğət. - M.
Boltzman sabiti- Bolcmano konstanta statusas T sritis fizika attikmenys: engl. Boltzmann daimi vok. Boltzmann Constante, f; Boltzmannsche Konstante, f rus. Boltzmann sabiti, f pranc. Constante de Boltzmann, f … Fizikos terminų žodynas
S entropiya ilə termodinamik ehtimal W arasında əlaqə S k lnW (k Boltzman sabiti). Termodinamikanın ikinci qanununun statistik şərhi Boltsman prinsipinə əsaslanır: təbii proseslər termodinamikanı dəyişdirməyə meyllidir... ...
- (Maksvell Boltsman paylanması) ideal qaz hissəciklərinin xarici qüvvə sahəsində (məsələn, qravitasiya sahəsində) enerji (E) ilə tarazlıq paylanması; f e E/kT paylanma funksiyası ilə müəyyən edilir, burada E kinetik və potensial enerjilərin cəmidir... Böyük ensiklopedik lüğət
Boltzmann sabiti ilə qarışdırılmamalıdır. Stefan Boltzmann sabiti (həmçinin Stefan sabiti), Stefan Boltzmann qanununda mütənasiblik sabiti olan fiziki sabit: vahid sahəyə buraxılan ümumi enerji... Wikipedia
Sabitin qiyməti Ölçü 1,380 6504(24)×10−23 J K−1 8,617 343(15)×10−5 eV K−1 1,3807×10−16 erg K−1 Boltsman sabiti (k və ya kb) fiziki sabit ki, temperatur və enerji arasındakı əlaqəni müəyyən edir. Avstriya... ... Vikipediyasının şərəfinə adlandırılmışdır
Molekulları klassikə tabe olan ideal qazın hissəciklərinin momentası və koordinatları üzərində statistik tarazlıq paylama funksiyası. mexanika, xarici potensial sahəsində: Burada Boltzman sabiti (universal sabit), mütləq... ... Riyaziyyat ensiklopediyası
Kitablar
- “Qaranlıq enerjisi” olmayan Kainat və fizika (kəşflər, ideyalar, fərziyyələr). 2 cilddə. 1-ci cild, O. G. Smirnov. Kitablar Q.Qalileydən, İ.Nyutondan, A.Eynşteyndən tutmuş bu günə kimi on və yüz illərlə elmdə mövcud olmuş fizika və astronomiya problemlərinə həsr olunub. Maddənin ən kiçik hissəcikləri və planetlər, ulduzlar və...
Stefan-Boltzman qanununa görə, inteqral yarımkürəvi şüalanmanın sıxlığı E 0 yalnız temperaturdan asılıdır və mütləq temperaturun dördüncü dərəcəsinə mütənasib olaraq dəyişir T:
Stefan-Boltzman sabiti σ 0 mütləq qara cismin tarazlıq istilik şüalanmasının həcm sıxlığını təyin edən qanuna daxil edilmiş fiziki sabitdir:

Tarixi olaraq, Stefan-Boltzmann qanunu Plankın radiasiya qanunundan əvvəl tərtib edilmişdir və nəticədə ondan irəli gəlir. Plank qanunu şüalanmanın spektral axınının sıxlığından asılılığını müəyyən edir E 0 dalğa uzunluğu λ və temperaturda T:

burada λ – dalğa uzunluğu, m; ilə=2,998 10 8 m/s – vakuumda işığın sürəti; T- bədən istiliyi, K;
h= 6,625 ×10 -34 J×s – Plank sabiti.
Fiziki sabit k, universal qaz sabitinin nisbətinə bərabərdir R=8314J/(kq×K) Avoqadro nömrəsinə N.A.=6,022× 10 26 1/(kq×mol):

Müxtəlif sistem konfiqurasiyalarının sayı N verilmiş ədədlər toplusu üçün hissəciklər n i(hissəciklərin sayı i-e i enerjisinin uyğun olduğu vəziyyət) qiymətə mütənasibdir:

Böyüklük W paylanmasının bir sıra yolları var N enerji səviyyələrinə görə hissəciklər. Əgər (6) əlaqəsi doğrudursa, ilkin sistemin Boltzman statistikasına tabe olduğu hesab edilir. Rəqəmlər dəsti n i, hansı nömrə W maksimum, ən tez-tez baş verir və ən ehtimal paylanmasına uyğundur.
Fiziki kinetika– statistik qeyri-tarazlıq sistemlərində proseslərin mikroskopik nəzəriyyəsi.
Çoxlu sayda hissəciklərin təsviri ehtimal metodlarından istifadə etməklə uğurla həyata keçirilə bilər. Monatomik qaz üçün bir sıra molekulların vəziyyəti onların koordinatları və müvafiq koordinat oxları üzrə sürət proyeksiyalarının qiymətləri ilə müəyyən edilir. Riyazi olaraq bu, hissəciyin verilmiş vəziyyətdə olma ehtimalını xarakterizə edən paylama funksiyası ilə təsvir edilir:

koordinatları +d, sürətləri isə +d diapazonunda olan d d həcmində molekulların gözlənilən sayıdır.
Əgər molekulların kinetik enerjisi ilə müqayisədə qarşılıqlı təsirinin zamanla orta potensial enerjisini nəzərə almamaq olarsa, qaz ideal adlanır. Bu qazdakı molekulların sərbəst yolunun axının xarakterik ölçüsünə nisbəti ideal qaza Boltsman qazı deyilir. Ləlbəttə, yəni.

çünki yolun uzunluğu tərs mütənasibdir nd 2(n ədədi sıxlıq 1/m 3, d molekulun diametri, m).
Ölçü
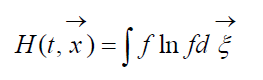
çağırdı H-Vahit həcm üçün Boltsman funksiyası, verilmiş vəziyyətdə qaz molekulları sisteminin aşkarlanması ehtimalı ilə bağlıdır. Hər bir vəziyyət, nəzərdən keçirilən molekulların faza sahəsinin bölünə biləcəyi altı ölçülü kosmik sürət hüceyrələrinin müəyyən sayda doldurulmasına uyğundur. işarə edək W nəzərdən keçirilən fəzanın birinci hüceyrəsində N 1 molekulların olma ehtimalı, ikincisində N 2 və s.
Ehtimalın mənşəyini təyin edən sabitə qədər aşağıdakı əlaqə etibarlıdır:
 ,
,
Harada 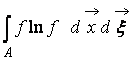 – Kosmos regionunun H funksiyası A qazla zəbt olunub. (9)-dan aydın olur ki W Və H bir-birinə bağlı, yəni. vəziyyətin ehtimalının dəyişməsi H funksiyasının müvafiq təkamülünə gətirib çıxarır.
– Kosmos regionunun H funksiyası A qazla zəbt olunub. (9)-dan aydın olur ki W Və H bir-birinə bağlı, yəni. vəziyyətin ehtimalının dəyişməsi H funksiyasının müvafiq təkamülünə gətirib çıxarır.

Boltzmann prinsipi entropiya arasında əlaqə yaradır S fiziki sistem və termodinamik ehtimal W onun dövlətləri:

(nəşrə görə nəşr edilmişdir: Kogan M.N. Nadir qazın dinamikası. - M.: Nauka, 1967.)
CUBE-nin ümumi görünüşü:

molekula təsir edən müxtəlif sahələrin (qravitasiya, elektrik, maqnit) olması səbəbindən kütlə qüvvəsi haradadır; J- toqquşma inteqralı. Boltzman tənliyinin məhz bu termini molekulların bir-biri ilə toqquşmasını və qarşılıqlı təsir göstərən hissəciklərin sürətlərindəki müvafiq dəyişiklikləri nəzərə alır. Toqquşma inteqralı beşölçülü inteqraldır və aşağıdakı quruluşa malikdir:

Heç bir tangensial qüvvələrin yaranmadığı molekulların toqquşması üçün inteqral (13) olan (12) tənliyi alınmışdır, yəni. toqquşan hissəciklər mükəmməl hamar hesab olunur.
Qarşılıqlı təsir zamanı molekulların daxili enerjisi dəyişmir, yəni. bu molekulların mükəmməl elastik olduğu qəbul edilir. Sürətlərə malik olan və bir-biri ilə toqquşmadan əvvəl (toqquşma) və toqquşmadan sonra, müvafiq olaraq, sürətləri və . Sürət fərqinə nisbi sürət deyilir, yəni. . Aydındır ki, hamar bir elastik toqquşma üçün. Paylama funksiyaları f 1 ", f", f 1 , f toqquşmalardan sonra və əvvəl müvafiq qrupların molekullarını təsvir edin, yəni. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

düyü. 1. İki molekulun toqquşması.
(13) toqquşan molekulların bir-birinə nisbətən yerini xarakterizə edən iki parametr daxildir: b və ε; b– nişan alma məsafəsi, yəni. qarşılıqlı təsir olmadıqda molekulların yaxınlaşacağı ən kiçik məsafə (şək. 2); ε toqquşma bucaq parametri adlanır (şək. 3). İnteqrasiya bitdi b 0-dan ¥-ə qədər və 0-dan 2p-ə qədər ((12)-də iki xarici inteqral) vektora perpendikulyar qüvvələr qarşılıqlı təsirinin bütün müstəvisini əhatə edir.

düyü. 2. Molekulların hərəkət trayektoriyası.

düyü. 3. Silindrik koordinat sistemində molekulların qarşılıqlı təsirinin nəzərə alınması: z, b, ε
Boltsman kinetik tənliyi aşağıdakı fərziyyələr və fərziyyələr əsasında alınır.
1. Hesab olunur ki, əsasən iki molekulun toqquşması baş verir, yəni. üç və ya daha çox molekulun eyni vaxtda toqquşmasının rolu əhəmiyyətsizdir. Bu fərziyyə analiz üçün yuxarıda sadəcə olaraq paylanma funksiyası adlanan tək hissəcikli paylanma funksiyasından istifadə etməyə imkan verir. Üç molekulun toqquşmasını nəzərə almaq tədqiqatda iki hissəcikli paylama funksiyasından istifadə etmək zərurətinə gətirib çıxarır. Müvafiq olaraq, təhlil əhəmiyyətli dərəcədə mürəkkəbləşir.
2. Molekulyar xaos fərziyyəsi. Faza nöqtəsində 1-ci hissəciyi və faza nöqtəsində 2-ci hissəciyi aşkar etmək ehtimallarının bir-birindən asılı olmaması ilə ifadə edilir.
3. Molekulların istənilən təsir məsafəsi ilə toqquşması eyni dərəcədə ehtimal olunur, yəni. paylama funksiyası qarşılıqlı diametrdə dəyişmir. Qeyd etmək lazımdır ki, təhlil edilən element kiçik olmalıdır ki f bu element daxilində dəyişmir, lakin eyni zamanda nisbi dalğalanma ~ böyük olmasın. Toqquşma inteqralının hesablanmasında istifadə olunan qarşılıqlı təsir potensialları sferik simmetrikdir, yəni. ![]() .
.
Maksvell-Boltzman paylanması
Qazın tarazlıq vəziyyəti Boltsman kinetik tənliyinin dəqiq həlli olan mütləq Maksvell paylanması ilə təsvir olunur:

burada m molekulun kütləsidir, kq.
Ümumi yerli Maksvell paylanması, başqa bir şəkildə Maksvell-Boltzman paylanması adlanır:

qaz bütövlükdə sürətlə hərəkət etdikdə və n, T dəyişənləri koordinatdan asılıdır.
və vaxt t.
Yerin qravitasiya sahəsində Boltzman tənliyinin dəqiq həlli aşağıdakıları göstərir:

Harada n 0 = Yer səthində sıxlıq, 1/m3; g– cazibə sürəti, m/s 2 ; h– hündürlük, m Formula (16) Boltzman kinetik tənliyinin ya qeyri-məhdud fəzada, ya da bu paylanmanı pozmayan sərhədlərin mövcudluğunda dəqiq həllidir, eyni zamanda temperatur da sabit qalmalıdır.
Bu səhifə Puzina Yu.Yu tərəfindən hazırlanmışdır. Rusiya Əsas Tədqiqatlar Fondunun dəstəyi ilə - layihə No 08-08-00638.
Boltzman sabiti ( və ya ) - temperatur və enerji arasındakı əlaqəni təyin edən fiziki sabit. Bu sabitin əsas rol oynadığı statistik fizikaya böyük töhfələr verən avstriyalı fizik Lüdviq Boltzmanın adını daşıyır. Beynəlxalq Vahidlər Sistemində (SI) onun eksperimental dəyəri:
J/.
Mötərizədə olan rəqəmlər kəmiyyət dəyərinin son rəqəmlərindəki standart xətanı göstərir. Plank vahidlərinin təbii sistemində temperaturun təbii vahidi Boltsman sabitinin vahidə bərabər olması üçün verilir.
Temperatur və enerji arasındakı əlaqə
Mütləq temperaturda homojen ideal qazda , Maksvell paylanmasından aşağıdakı kimi hər bir tərcümə sərbəstlik dərəcəsi üçün enerji bərabərdir, . Otaq temperaturunda (300 ) bu enerjidir J və ya 0,013 eV. Monatomik ideal qazda hər bir atom üç fəza oxuna uyğun gələn üç sərbəstlik dərəcəsinə malikdir, yəni hər atomun enerjisi .
İstilik enerjisini bilməklə, atom kütləsinin kvadrat kökü ilə tərs mütənasib olan atomların orta kvadrat sürətini hesablaya bilərik. Otaq temperaturunda orta kvadrat sürət helium üçün 1370 m/s-dən ksenon üçün 240 m/s arasında dəyişir. Molekulyar qaz vəziyyətində vəziyyət daha da mürəkkəbləşir, məsələn, iki atomlu qaz beş dərəcə sərbəstliyə malikdir (aşağı temperaturda, molekuldakı atomların titrəmələri həyəcanlanmadıqda).
Entropiyanın tərifi
Termodinamik sistemin entropiyası müxtəlif mikrovəziyyətlərin sayının təbii loqarifmi kimi müəyyən edilir. , verilmiş makroskopik vəziyyətə uyğundur (məsələn, verilmiş ümumi enerjiyə malik vəziyyət).
Proporsionallıq faktoru və Boltsman sabitidir. Bu, mikroskopik ( ) və makroskopik vəziyyətlər ( ), statistik mexanikanın mərkəzi fikrini ifadə edir.
Güman edilən dəyər fiksasiyası
2011-ci il oktyabrın 17-21-də keçirilmiş Çəkilər və Ölçülər üzrə XXIV Baş Konfransda qətnamə qəbul edilmişdir ki, burada xüsusilə Beynəlxalq Vahidlər Sisteminin gələcək yenidən baxılmasının elə bir şəkildə həyata keçirilməsi təklif edilmişdir. Boltzman sabitinin qiymətini təyin edin, bundan sonra o, müəyyən hesab ediləcək tam olaraq. Nəticədə icra olunacaq dəqiq bərabərlik k=1,380 6X 10 −23 J/K. Bu iddia edilən fiksasiya, Kelvin termodinamik temperatur vahidinin dəyərini Boltzman sabitinin dəyəri ilə əlaqələndirmək istəyi ilə əlaqələndirilir.
həmçinin bax
"Boltzmann's Constant" məqaləsi haqqında rəy yazın
Qeydlər
| Bu, termodinamika və statistik fizikaya dair qaralama məqalədir. Layihəyə əlavə etməklə ona kömək edə bilərsiniz. |
Boltzmanın Sabitini xarakterizə edən bir parça
- Bəs bu nə deməkdir? – Nataşa fikirli halda dedi.- Oh, bütün bunların nə qədər qeyri-adi olduğunu bilmirəm! - Sonya başını tutaraq dedi.
Bir neçə dəqiqədən sonra knyaz Andrey zəng etdi və Nataşa onu görməyə gəldi; Sonya isə nadir hallarda yaşadığı bir duyğu və zərifliyi yaşayır, baş verənlərin fövqəladə təbiəti barədə fikirləşərək pəncərədə qalırdı.
Bu gün orduya məktub göndərmək imkanı yarandı və qrafinya oğluna məktub yazdı.
"Sonya" dedi, qardaşı qızı onun yanından keçəndə qrafinya məktubdan başını qaldırdı. - Sonya, Nikolenkoya yazmazsan? - qrafinya sakit, titrək səslə dedi və eynəkdən baxan yorğun gözlərinin görünüşündə Sonya qrafinyanın bu sözlərdən başa düşdüyü hər şeyi oxudu. Bu baxışda yalvarış, imtina qorxusu, soruşmaq məcburiyyətindən utanmaq və imtina halında barışmaz nifrətə hazır olmaq ifadə edilirdi.
Sonya qrafinyanın yanına getdi və diz çökərək onun əlindən öpdü.
"Yazacağam, ana" dedi.
Sonya o gün baş verən hər şeydən, xüsusən də indicə gördüyü müəmmalı falçılıqdan yumşaldı, həyəcanlandı və təsirləndi. İndi o, Nataşanın Şahzadə Andrey ilə münasibətlərinin yenilənməsi münasibətilə Nikolayın Şahzadə Məryəmlə evlənə bilməyəcəyini bildiyindən, sevdiyi və yaşamağa öyrəşdiyi fədakarlıq əhval-ruhiyyəsinin qayıdışını sevinclə hiss etdi. O, göz yaşları içində və səxavətli bir əməlin həyata keçirilməsinin sevinci ilə, məxmər kimi qara gözlərini bulandıran göz yaşları ilə bir neçə dəfə sözünü kəsərək, alınması Nikolayı heyrətə gətirən o təsirli məktubu yazdı.
Pierrenin aparıldığı qarovulda onu aparan zabit və əsgərlər ona düşməncəsinə, eyni zamanda hörmətlə yanaşdılar. Onunla münasibətdə hələ də onun kim olduğuna dair şübhə (çox vacib bir insan olub-olmaması) və onunla hələ də təzə şəxsi mübarizə apardıqları üçün düşmənçilik hiss olunurdu.
Ancaq başqa bir günün səhəri növbə gələndə Pierre hiss etdi ki, yeni mühafizəçi üçün - zabitlər və əsgərlər üçün - artıq onu götürənlər üçün mənası yoxdur. Və doğrudan da, kəndli kaftanında olan bu iri, kök adamda ertəsi gün mühafizəçilər qarətçi və müşayiətçi əsgərlərlə bu qədər ümidsiz döyüşən və uşağı xilas etmək barədə təntənəli bir söz deyən o canlı adamı daha görmədilər, amma gördülər. nədənsə ən yüksək orqanların əmri ilə saxlanılanların yalnız on yeddincisi əsir götürülmüş ruslardır. Pierre haqqında xüsusi bir şey varsa, bu, yalnız onun qorxaq, diqqətlə düşünülmüş görünüşü və fransızlar üçün təəccüblü bir şəkildə yaxşı danışdığı fransız dili idi. Baxmayaraq ki, həmin gün Pierre digər şübhəli şəxslərlə əlaqədə idi, çünki onun tutduğu ayrı otaq bir məmura lazım idi.
Pierre ilə birlikdə saxlanılan bütün ruslar ən aşağı rütbəli insanlar idi. Hamısı Pyeri ustad kimi tanıyaraq, xüsusən də fransızca danışdığı üçün ondan qaçırdılar. Pierre özünün istehzasını kədərlə eşitdi.
Ertəsi axşam Pierre öyrəndi ki, bu məhbusların hamısı (və yəqin ki, özü də daxil olmaqla) yanğına görə mühakimə olunacaqlar. Üçüncü gün Pierre başqaları ilə birlikdə ağ bığlı bir fransız generalının, iki polkovnikin və əllərində yaylıq olan digər fransızların oturduğu evə aparıldı. Pierre, başqaları ilə birlikdə, şübhəlilərin insan zəif cəhətlərini aşaraq, adətən müttəhimlərlə rəftar edildiyi dəqiqlik və əminliklə kim olduğu barədə suallar verildi. o harda idi? nə məqsədlə? və s.
Həyat məsələsinin mahiyyətini bir kənara qoyaraq və bu mahiyyəti üzə çıxarmaq imkanını istisna edən bu suallar, məhkəmələrdə verilən bütün suallar kimi, yalnız hakimlərin cavabdehin cavablarının axmasını istədikləri çuxur yaratmaq məqsədi daşıyırdı. arzu olunan məqsəd, yəni ittihamdır. İttihamın məqsədini qane etməyən sözlər deməyə başlayan kimi yiv götürdülər, su hara istəsə axsın. Bundan əlavə, Pierre, müttəhimin bütün məhkəmələrdə yaşadığı eyni şeyi yaşadı: bütün bu sualların ondan niyə soruşulduğuna dair çaşqınlıq. O, hiss edirdi ki, bu yiv salmaq hiyləsi yalnız təvazökarlıqdan və ya sanki nəzakətdən istifadə olunur. Bilirdi ki, bu adamların ixtiyarındadır, onu bura ancaq güc gətirib, onlara suallara cavab tələb etmək hüququ yalnız güc verir, bu görüşün yeganə məqsədi onu ittiham etməkdir. Və ona görə də güc olduğu üçün, ittiham etmək istəyi olduğu üçün sual və məhkəmə hiyləsinə ehtiyac yox idi. Aydın idi ki, bütün cavablar günaha səbəb olmalı idi. Onu aparanda nə etdiyini soruşduqda, Pierre bir faciə ilə cavab verdi ki, uşağı valideynlərinə aparır, qu"il avait sauve des flammes [kimi alovdan xilas etdi]. - Niyə qarətçi ilə vuruşdu. ?Pyer cavab verdi ki, o qadını müdafiə edir, təhqir olunmuş qadını qorumaq hər bir insanın borcudur, ki... Onu dayandırdılar: bu sözə getmədi.Niyə o, evin həyətində yanırdı. , şahidlər onu harada görüblər?O cavab verdi ki, Moskvada nə baş verdiyinə baxmağa gedirəm.Yenə saxladılar: hara getdiyini soruşmadılar və niyə yanğının yanında idi?Kim idi?Təkrarladılar. ilk sualına cavab vermək istəmədiyini dedi.Yenə belə deyə bilməyəcəyini bildirdi.
Mötərizədə olan rəqəmlər kəmiyyət dəyərinin son rəqəmlərindəki standart xətanı göstərir. Prinsipcə, Boltzman sabitini mütləq temperaturun və digər fiziki sabitlərin tərifindən əldə etmək olar (bunun üçün birinci prinsiplərdən suyun üçqat nöqtəsinin temperaturunu hesablamağı bacarmaq lazımdır). Lakin birinci prinsiplərdən istifadə edərək Boltsman sabitinin müəyyən edilməsi bu sahədə biliyin hazırkı inkişafı ilə çox mürəkkəb və qeyri-realdır.
Boltzmann sabiti, temperaturu enerji vahidləri ilə ölçsəniz, fizikada çox vaxt edilən lazımsız fiziki sabitdir. Bu, əslində, dəqiq müəyyən edilmiş kəmiyyət - enerji və dərəcə arasında əlaqədir, mənası tarixən inkişaf etmişdir.
Entropiyanın tərifi
Termodinamik sistemin entropiyası verilmiş makroskopik vəziyyətə (məsələn, verilmiş ümumi enerjiyə malik vəziyyətlərə) uyğun gələn müxtəlif mikrodövlətlərin Z sayının təbii loqarifmi kimi müəyyən edilir.
Proporsionallıq faktoru k və Boltsman sabitidir. Mikroskopik (Z) və makroskopik (S) xüsusiyyətlər arasındakı əlaqəni təyin edən bu ifadə statistik mexanikanın əsas (mərkəzi) fikrini ifadə edir.