Διάσταση της σταθεράς του Boltzmann. Ludwig Boltzmann: Προσωπικά επιτεύγματα
Σταθερά Boltzmann (k (\displaystyle k)ή k B (\displaystyle k_(\rm (B)))) - μια φυσική σταθερά που ορίζει τη σχέση μεταξύ θερμοκρασίας και ενέργειας. Πήρε το όνομά του από τον Αυστριακό φυσικό Ludwig Boltzmann, ο οποίος συνέβαλε σημαντικά στη στατιστική φυσική, στην οποία αυτή η σταθερά παίζει βασικό ρόλο. Η τιμή του στο Διεθνές Σύστημα Μονάδων SI σύμφωνα με τις αλλαγές στους ορισμούς των βασικών μονάδων SI (2018) είναι ακριβώς ίση με
k = 1,380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\ φορές 10^(-23)) J/.Σχέση θερμοκρασίας και ενέργειας
Σε ένα ομοιογενές ιδανικό αέριο σε απόλυτη θερμοκρασία T (\displaystyle T), η ενέργεια για κάθε μεταφραστικό βαθμό ελευθερίας είναι ίση, όπως προκύπτει από την κατανομή Maxwell, k T / 2 (\displaystyle kT/2). Σε θερμοκρασία δωματίου (300 ) αυτή η ενέργεια είναι 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J, ή 0,013 eV. Σε ένα μονοατομικό ιδανικό αέριο, κάθε άτομο έχει τρεις βαθμούς ελευθερίας που αντιστοιχούν σε τρεις χωρικούς άξονες, που σημαίνει ότι κάθε άτομο έχει ενέργεια ίση με 3 2 k T (\displaystyle (\frac (3)(2))kT).
Γνωρίζοντας τη θερμική ενέργεια, μπορούμε να υπολογίσουμε τη ρίζα της μέσης τετραγωνικής ταχύτητας των ατόμων, η οποία είναι αντιστρόφως ανάλογη με την τετραγωνική ρίζα της ατομικής μάζας. Η μέση τετραγωνική ταχύτητα ρίζας σε θερμοκρασία δωματίου κυμαίνεται από 1370 m/s για το ήλιο έως 240 m/s για το ξένο. Στην περίπτωση ενός μοριακού αερίου, η κατάσταση γίνεται πιο περίπλοκη, για παράδειγμα, ένα διατομικό αέριο έχει 5 βαθμούς ελευθερίας - 3 μεταφορικές και 2 περιστροφικές (σε χαμηλές θερμοκρασίες, όταν οι δονήσεις των ατόμων στο μόριο δεν διεγείρονται και επιπλέον βαθμούς η ελευθερία δεν προστίθεται).
Ορισμός της εντροπίας
Η εντροπία ενός θερμοδυναμικού συστήματος ορίζεται ως ο φυσικός λογάριθμος του αριθμού των διαφορετικών μικροκαταστάσεων Z (\displaystyle Z), που αντιστοιχεί σε μια δεδομένη μακροσκοπική κατάσταση (για παράδειγμα, μια κατάσταση με μια δεδομένη συνολική ενέργεια).
S = k ln Z . (\displaystyle S=k\ln Z.)Συντελεστής αναλογικότητας k (\displaystyle k)και είναι η σταθερά του Boltzmann. Αυτή είναι μια έκφραση που ορίζει τη σχέση μεταξύ μικροσκοπικής ( Z (\displaystyle Z)) και μακροσκοπικές καταστάσεις ( S (\displaystyle S)), εκφράζει την κεντρική ιδέα της στατιστικής μηχανικής.
Η καθοριστική σχέση μεταξύ θερμοκρασίας και ενέργειας. Πήρε το όνομά του από τον Αυστριακό φυσικό Ludwig Boltzmann, ο οποίος συνέβαλε σημαντικά στη στατιστική φυσική, στην οποία αυτή η σταθερά παίζει βασικό ρόλο. Η πειραματική του τιμή στο Διεθνές Σύστημα Μονάδων (SI) είναι:
J/.Οι αριθμοί στις παρενθέσεις υποδεικνύουν το τυπικό σφάλμα στα τελευταία ψηφία της τιμής της ποσότητας. Η σταθερά του Boltzmann μπορεί να ληφθεί από τον ορισμό της απόλυτης θερμοκρασίας και άλλων φυσικών σταθερών. Ωστόσο, ο υπολογισμός της σταθεράς του Boltzmann χρησιμοποιώντας τις πρώτες αρχές είναι πολύ περίπλοκος και ανέφικτος με την τρέχουσα κατάσταση γνώσης. Στο φυσικό σύστημα των μονάδων Planck, η φυσική μονάδα θερμοκρασίας δίνεται έτσι ώστε η σταθερά του Boltzmann να είναι ίση με τη μονάδα.
Σχέση θερμοκρασίας και ενέργειας
Σε ένα ομοιογενές ιδανικό αέριο σε απόλυτη θερμοκρασία, η ενέργεια ανά μεταφραστικό βαθμό ελευθερίας είναι, όπως προκύπτει από την κατανομή Maxwell, . Σε θερμοκρασία δωματίου (300°C) αυτή η ενέργεια είναι J, ή 0,013 eV. Σε ένα μονοατομικό ιδανικό αέριο, κάθε άτομο έχει τρεις βαθμούς ελευθερίας που αντιστοιχούν σε τρεις χωρικούς άξονες, που σημαίνει ότι κάθε άτομο έχει ενέργεια ίσου με .
Γνωρίζοντας τη θερμική ενέργεια, μπορούμε να υπολογίσουμε τη ρίζα της μέσης τετραγωνικής ταχύτητας των ατόμων, η οποία είναι αντιστρόφως ανάλογη με την τετραγωνική ρίζα της ατομικής μάζας. Η μέση τετραγωνική ταχύτητα ρίζας σε θερμοκρασία δωματίου κυμαίνεται από 1370 m/s για το ήλιο έως 240 m/s για το ξένο. Στην περίπτωση ενός μοριακού αερίου, η κατάσταση γίνεται πιο περίπλοκη, για παράδειγμα, ένα διατομικό αέριο έχει περίπου πέντε βαθμούς ελευθερίας.
Ορισμός της εντροπίας
Η εντροπία ενός θερμοδυναμικού συστήματος ορίζεται ως ο φυσικός λογάριθμος του αριθμού των διακριτών μικροκαταστάσεων που αντιστοιχούν σε μια δεδομένη μακροσκοπική κατάσταση (για παράδειγμα, μια κατάσταση με μια δεδομένη συνολική ενέργεια).
Ο συντελεστής αναλογικότητας είναι η σταθερά του Boltzmann. Αυτή η έκφραση, η οποία ορίζει τη σύνδεση μεταξύ μικροσκοπικών () και μακροσκοπικών καταστάσεων (), εκφράζει την κεντρική ιδέα της στατιστικής μηχανικής.
δείτε επίσης
Σημειώσεις
Ίδρυμα Wikimedia. 2010.
Δείτε τι είναι η "σταθερά του Boltzmann" σε άλλα λεξικά:
- (σύμβολο k), ο λόγος της καθολικής σταθεράς του ΑΕΡΙΟΥ προς τον ΑΡΙΘΜΟ AVOGADRO, ίσος με 1.381.10 23 τζάουλ ανά βαθμό Κέλβιν. Δείχνει τη σχέση μεταξύ της κινητικής ενέργειας ενός σωματιδίου αερίου (ατόμου ή μορίου) και της απόλυτης θερμοκρασίας του... ... Επιστημονικό και τεχνικό εγκυκλοπαιδικό λεξικό
Σταθερά Boltzmann- - [A.S. Goldberg. Αγγλο-ρωσικό ενεργειακό λεξικό. 2006] Ενεργειακά θέματα γενικά EN Boltzmann σταθερά ... Οδηγός Τεχνικού Μεταφραστή
Η σταθερά του Boltzmann- Boltzmann Constant Boltzmann Constant Μια φυσική σταθερά που ορίζει τη σχέση μεταξύ θερμοκρασίας και ενέργειας. Πήρε το όνομά του από τον Αυστριακό φυσικό Ludwig Boltzmann, ο οποίος συνέβαλε σημαντικά στη στατιστική φυσική, στην οποία αυτή η σταθερή ... Επεξηγηματικό Αγγλο-Ρωσικό λεξικό για τη νανοτεχνολογία. - Μ.
Σταθερά Boltzmann- Bolcmano konstanta statusas T sritis fizika atitikmenys: αγγλ. Boltzmann συνεχής vok. Boltzmann Constante, f; Boltzmannsche Konstante, f rus. Boltzmann σταθερά, f pranc. Constante de Boltzmann, f … Fizikos terminų žodynas
Σχέση S k lnW μεταξύ της εντροπίας S και της θερμοδυναμικής πιθανότητας W (k σταθερά Boltzmann). Η στατιστική ερμηνεία του δεύτερου νόμου της θερμοδυναμικής βασίζεται στην αρχή Boltzmann: οι φυσικές διεργασίες τείνουν να μετασχηματίσουν τη θερμοδυναμική... ...
- (κατανομή Maxwell Boltzmann) κατανομή ισορροπίας σωματιδίων ιδανικών αερίων με ενέργεια (E) σε ένα εξωτερικό πεδίο δύναμης (για παράδειγμα, σε ένα βαρυτικό πεδίο). καθορίζεται από τη συνάρτηση κατανομής f e E/kT, όπου E είναι το άθροισμα των κινητικών και δυνητικών ενεργειών... Μεγάλο Εγκυκλοπαιδικό Λεξικό
Δεν πρέπει να συγχέεται με τη σταθερά του Boltzmann. Η σταθερά του Stefan Boltzmann (επίσης η σταθερά του Stefan), μια φυσική σταθερά που είναι η σταθερά της αναλογικότητας στο νόμο του Stefan Boltzmann: η συνολική ενέργεια που εκπέμπεται ανά μονάδα επιφάνειας... Wikipedia
Τιμή της σταθεράς Διάσταση 1,380 6504(24)×10−23 J K−1 8,617 343(15)×10−5 eV K−1 1,3807×10−16 erg K−1 Σταθερά Boltzmann (k ή kb) μια φυσική σταθερά που ορίζει τη σχέση θερμοκρασίας και ενέργειας. Πήρε το όνομά του από την Αυστριακή... ... Wikipedia
Στατιστικά συνάρτηση κατανομής ισορροπίας πάνω στη ροπή και τις συντεταγμένες των σωματιδίων ενός ιδανικού αερίου, τα μόρια του οποίου υπακούουν στην κλασική. μηχανική, σε ένα εξωτερικό πεδίο δυναμικού: Εδώ η σταθερά Boltzmann (καθολική σταθερά), απόλυτη... ... Μαθηματική Εγκυκλοπαίδεια
Βιβλία
- Σύμπαν και φυσική χωρίς «σκοτεινή ενέργεια» (ανακαλύψεις, ιδέες, υποθέσεις). Σε 2 τόμους. Τόμος 1, O. G. Smirnov. Τα βιβλία είναι αφιερωμένα σε προβλήματα φυσικής και αστρονομίας που υπάρχουν στην επιστήμη εδώ και δεκάδες και εκατοντάδες χρόνια από τον Γ. Γαλιλαίο, τον Ι. Νεύτωνα, τον Α. Αϊνστάιν μέχρι σήμερα. Τα μικρότερα σωματίδια ύλης και πλανήτες, αστέρια και...
Σύμφωνα με το νόμο Stefan-Boltzmann, η πυκνότητα της ενιαίας ημισφαιρικής ακτινοβολίας Ε 0εξαρτάται μόνο από τη θερμοκρασία και μεταβάλλεται αναλογικά με την τέταρτη δύναμη της απόλυτης θερμοκρασίας Τ:
Η σταθερά Stefan–Boltzmann σ 0 είναι μια φυσική σταθερά που περιλαμβάνεται στον νόμο που καθορίζει την ογκομετρική πυκνότητα της θερμικής ακτινοβολίας ισορροπίας ενός απολύτως μαύρου σώματος:

Ιστορικά, ο νόμος Stefan-Boltzmann διατυπώθηκε πριν από τον νόμο ακτινοβολίας του Planck, από τον οποίο προκύπτει ως συνέπεια. Ο νόμος του Planck καθιερώνει την εξάρτηση της πυκνότητας της φασματικής ροής της ακτινοβολίας μι 0 σε μήκος κύματος λ και θερμοκρασία Τ:

όπου λ – μήκος κύματος, m; Με=2.998 10 8 m/s – ταχύτητα φωτός στο κενό; Τ– θερμοκρασία σώματος, K;
η= 6,625 × 10 -34 J×s – Η σταθερά του Planck.
Φυσική σταθερά κ, ίσο με τον λόγο της καθολικής σταθεράς αερίου R=8314J/(kg×K) στον αριθμό του Avogadro Ν.Α.=6,022× 10 26 1/(kg×mol):

Αριθμός διαφορετικών διαμορφώσεων συστήματος από Νσωματίδια για ένα δεδομένο σύνολο αριθμών n i(αριθμός σωματιδίων σε Εγώ-η κατάσταση στην οποία αντιστοιχεί η ενέργεια e i) είναι ανάλογη της τιμής:

Μέγεθος Wυπάρχουν διάφοροι τρόποι διανομής Νσωματίδια ανά ενεργειακά επίπεδα. Εάν η σχέση (6) είναι αληθής, τότε θεωρείται ότι το αρχικό σύστημα υπακούει στις στατιστικές Boltzmann. Σύνολο αριθμών n i, στον οποίο ο αριθμός Wμέγιστο, εμφανίζεται πιο συχνά και αντιστοιχεί στην πιο πιθανή κατανομή.
Φυσική κινητική– μικροσκοπική θεωρία διεργασιών σε συστήματα στατιστικά μη ισορροπίας.
Η περιγραφή ενός μεγάλου αριθμού σωματιδίων μπορεί να πραγματοποιηθεί με επιτυχία χρησιμοποιώντας πιθανολογικές μεθόδους. Για ένα μονοατομικό αέριο, η κατάσταση ενός συνόλου μορίων καθορίζεται από τις συντεταγμένες τους και τις τιμές των προβολών ταχύτητας στους αντίστοιχους άξονες συντεταγμένων. Μαθηματικά, αυτό περιγράφεται από τη συνάρτηση κατανομής, η οποία χαρακτηρίζει την πιθανότητα ένα σωματίδιο να βρίσκεται σε μια δεδομένη κατάσταση:

είναι ο αναμενόμενος αριθμός μορίων σε έναν όγκο d d του οποίου οι συντεταγμένες είναι στην περιοχή από +d και των οποίων οι ταχύτητες είναι στην περιοχή από έως +d.
Εάν η μέση χρονικά δυναμική ενέργεια της αλληλεπίδρασης των μορίων μπορεί να παραμεληθεί σε σύγκριση με την κινητική τους ενέργεια, τότε το αέριο ονομάζεται ιδανικό. Ένα ιδανικό αέριο ονομάζεται αέριο Boltzmann εάν ο λόγος του μήκους διαδρομής των μορίων σε αυτό το αέριο προς το χαρακτηριστικό μέγεθος της ροής μεγάλοφυσικά, δηλ.

επειδή το μήκος της διαδρομής είναι αντιστρόφως ανάλογο και 2(n είναι η αριθμητική πυκνότητα 1/m 3, d είναι η διάμετρος του μορίου, m).
Μέγεθος
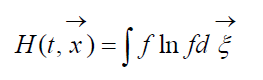
που ονομάζεται H-Συνάρτηση Boltzmann για μονάδα όγκου, η οποία σχετίζεται με την πιθανότητα ανίχνευσης ενός συστήματος μορίων αερίου σε μια δεδομένη κατάσταση. Κάθε κατάσταση αντιστοιχεί σε ορισμένους αριθμούς πλήρωσης εξαδιάστατων κυψελών διαστημικής ταχύτητας στα οποία μπορεί να διαιρεθεί ο χώρος φάσης των υπό εξέταση μορίων. Ας υποδηλώσουμε Wτην πιθανότητα να υπάρχουν μόρια N 1 στο πρώτο κελί του υπό εξέταση χώρου, N 2 στο δεύτερο κ.λπ.
Μέχρι μια σταθερά που καθορίζει την προέλευση της πιθανότητας, ισχύει η ακόλουθη σχέση:
 ,
,
Οπου 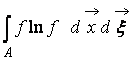 – H-συνάρτηση μιας περιοχής του χώρου ΕΝΑκαταλαμβάνεται από αέριο. Από το (9) είναι σαφές ότι WΚαι Hαλληλένδετα, δηλ. μια αλλαγή στην πιθανότητα μιας κατάστασης οδηγεί σε αντίστοιχη εξέλιξη της συνάρτησης H.
– H-συνάρτηση μιας περιοχής του χώρου ΕΝΑκαταλαμβάνεται από αέριο. Από το (9) είναι σαφές ότι WΚαι Hαλληλένδετα, δηλ. μια αλλαγή στην πιθανότητα μιας κατάστασης οδηγεί σε αντίστοιχη εξέλιξη της συνάρτησης H.

Η αρχή του Boltzmann καθιερώνει τη σύνδεση μεταξύ της εντροπίας μικρόφυσικό σύστημα και θερμοδυναμική πιθανότητα Wη ίδια αναφέρει:

(δημοσιεύεται σύμφωνα με τη δημοσίευση: Kogan M.N. Dynamics of a rarefied gas. - M.: Nauka, 1967.)
Γενική άποψη του CUBE:

πού είναι η δύναμη μάζας που οφείλεται στην παρουσία διαφόρων πεδίων (βαρυτικών, ηλεκτρικών, μαγνητικών) που δρουν στο μόριο. J– ολοκλήρωμα σύγκρουσης. Είναι αυτός ο όρος της εξίσωσης Boltzmann που λαμβάνει υπόψη τις συγκρούσεις των μορίων μεταξύ τους και τις αντίστοιχες αλλαγές στις ταχύτητες των σωματιδίων που αλληλεπιδρούν. Το ολοκλήρωμα σύγκρουσης είναι ένα πενταδιάστατο ολοκλήρωμα και έχει την ακόλουθη δομή:

Η εξίσωση (12) με το ολοκλήρωμα (13) προέκυψε για συγκρούσεις μορίων στις οποίες δεν προκύπτουν εφαπτομενικές δυνάμεις, δηλ. τα συγκρουόμενα σωματίδια θεωρούνται απολύτως ομαλά.
Κατά την αλληλεπίδραση δεν μεταβάλλεται η εσωτερική ενέργεια των μορίων, δηλ. αυτά τα μόρια υποτίθεται ότι είναι απόλυτα ελαστικά. Θεωρούμε δύο ομάδες μορίων που έχουν ταχύτητες και πριν συγκρουστούν μεταξύ τους (σύγκρουση) (Σχ. 1), και μετά τη σύγκρουση, αντίστοιχα, ταχύτητες και . Η διαφορά στην ταχύτητα ονομάζεται σχετική ταχύτητα, δηλ. . Είναι σαφές ότι για μια ομαλή ελαστική σύγκρουση . Λειτουργίες διανομής f 1 ", f", f 1 , fπεριγράψτε τα μόρια των αντίστοιχων ομάδων μετά και πριν από τις συγκρούσεις, δηλ. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Ρύζι. 1. Σύγκρουση δύο μορίων.
(13) περιλαμβάνει δύο παραμέτρους που χαρακτηρίζουν τη θέση των συγκρουόμενων μορίων μεταξύ τους: σικαι ε? σι– απόσταση σκόπευσης, δηλ. η μικρότερη απόσταση που θα πλησίαζαν τα μόρια απουσία αλληλεπίδρασης (Εικ. 2). Το ε ονομάζεται γωνιακή παράμετρος σύγκρουσης (Εικ. 3). Η ενσωμάτωση τελείωσε σιαπό 0 έως ¥ και από 0 έως 2p (δύο εξωτερικά ολοκληρώματα στο (12)) καλύπτει ολόκληρο το επίπεδο αλληλεπίδρασης δύναμης κάθετο στο διάνυσμα

Ρύζι. 2. Η τροχιά των μορίων.

Ρύζι. 3. Εξέταση της αλληλεπίδρασης μορίων σε ένα κυλινδρικό σύστημα συντεταγμένων: z, σι, ε
Η κινητική εξίσωση Boltzmann προκύπτει από τις ακόλουθες παραδοχές και παραδοχές.
1. Πιστεύεται ότι συμβαίνουν κυρίως συγκρούσεις δύο μορίων, δηλ. ο ρόλος των συγκρούσεων τριών ή περισσότερων μορίων ταυτόχρονα είναι ασήμαντος. Αυτή η υπόθεση μας επιτρέπει να χρησιμοποιήσουμε μια συνάρτηση κατανομής ενός σωματιδίου για ανάλυση, η οποία παραπάνω ονομάζεται απλώς συνάρτηση κατανομής. Λαμβάνοντας υπόψη τη σύγκρουση τριών μορίων οδηγεί στην ανάγκη χρήσης μιας συνάρτησης κατανομής δύο σωματιδίων στη μελέτη. Κατά συνέπεια, η ανάλυση γίνεται πολύ πιο περίπλοκη.
2. Παραδοχή μοριακού χάους. Εκφράζεται στο γεγονός ότι οι πιθανότητες ανίχνευσης του σωματιδίου 1 στο σημείο φάσης και του σωματιδίου 2 στο σημείο φάσης είναι ανεξάρτητες μεταξύ τους.
3. Οι συγκρούσεις μορίων με οποιαδήποτε απόσταση κρούσης είναι εξίσου πιθανές, δηλ. η συνάρτηση κατανομής δεν αλλάζει στη διάμετρο αλληλεπίδρασης. Πρέπει να σημειωθεί ότι το αναλυόμενο στοιχείο πρέπει να είναι μικρό ώστε φάμέσα σε αυτό το στοιχείο δεν αλλάζει, αλλά ταυτόχρονα έτσι ώστε η σχετική διακύμανση ~ να μην είναι μεγάλη. Τα δυναμικά αλληλεπίδρασης που χρησιμοποιούνται για τον υπολογισμό του ολοκληρώματος σύγκρουσης είναι σφαιρικά συμμετρικά, δηλ. ![]() .
.
Κατανομή Maxwell-Boltzmann
Η κατάσταση ισορροπίας του αερίου περιγράφεται από την απόλυτη κατανομή Maxwellian, η οποία είναι μια ακριβής λύση της κινητικής εξίσωσης Boltzmann:

όπου m είναι η μάζα του μορίου, kg.
Η γενική τοπική κατανομή Maxwellian, που αλλιώς ονομάζεται κατανομή Maxwell-Boltzmann:

στην περίπτωση που το αέριο κινείται ως σύνολο με ταχύτητα και οι μεταβλητές n, T εξαρτώνται από τη συντεταγμένη
και χρόνος t.
Στο βαρυτικό πεδίο της Γης, η ακριβής λύση της εξίσωσης Boltzmann δείχνει:

Οπου n 0 = πυκνότητα στην επιφάνεια της Γης, 1/m3; σολ– επιτάχυνση βαρύτητας, m/s 2 ; η– ύψος, μ. Ο τύπος (16) είναι ακριβής λύση της κινητικής εξίσωσης Boltzmann είτε σε απεριόριστο χώρο είτε με την παρουσία ορίων που δεν παραβιάζουν αυτή την κατανομή, ενώ η θερμοκρασία πρέπει επίσης να παραμένει σταθερή.
Αυτή η σελίδα σχεδιάστηκε από την Puzina Yu.Yu. με την υποστήριξη του Ρωσικού Ιδρύματος Βασικής Έρευνας - έργο αρ. 08-08-00638.
Σταθερά Boltzmann (ή ) - μια φυσική σταθερά που ορίζει τη σχέση μεταξύ θερμοκρασίας και ενέργειας. Πήρε το όνομά του από τον Αυστριακό φυσικό Ludwig Boltzmann, ο οποίος συνέβαλε σημαντικά στη στατιστική φυσική, στην οποία αυτή η σταθερά παίζει βασικό ρόλο. Η πειραματική του τιμή στο Διεθνές Σύστημα Μονάδων (SI) είναι:
J/.
Οι αριθμοί στις παρενθέσεις υποδεικνύουν το τυπικό σφάλμα στα τελευταία ψηφία της τιμής της ποσότητας. Στο φυσικό σύστημα των μονάδων Planck, η φυσική μονάδα θερμοκρασίας δίνεται έτσι ώστε η σταθερά του Boltzmann να είναι ίση με τη μονάδα.
Σχέση θερμοκρασίας και ενέργειας
Σε ένα ομοιογενές ιδανικό αέριο σε απόλυτη θερμοκρασία , η ενέργεια για κάθε μεταφραστικό βαθμό ελευθερίας είναι ίση, όπως προκύπτει από την κατανομή Maxwell, . Σε θερμοκρασία δωματίου (300 ) αυτή η ενέργεια είναι J, ή 0,013 eV. Σε ένα μονοατομικό ιδανικό αέριο, κάθε άτομο έχει τρεις βαθμούς ελευθερίας που αντιστοιχούν σε τρεις χωρικούς άξονες, που σημαίνει ότι κάθε άτομο έχει ενέργεια ίση με .
Γνωρίζοντας τη θερμική ενέργεια, μπορούμε να υπολογίσουμε τη ρίζα της μέσης τετραγωνικής ταχύτητας των ατόμων, η οποία είναι αντιστρόφως ανάλογη με την τετραγωνική ρίζα της ατομικής μάζας. Η μέση τετραγωνική ταχύτητα ρίζας σε θερμοκρασία δωματίου κυμαίνεται από 1370 m/s για το ήλιο έως 240 m/s για το ξένο. Στην περίπτωση ενός μοριακού αερίου, η κατάσταση γίνεται πιο περίπλοκη, για παράδειγμα, ένα διατομικό αέριο έχει πέντε βαθμούς ελευθερίας (σε χαμηλές θερμοκρασίες, όταν οι δονήσεις των ατόμων στο μόριο δεν διεγείρονται).
Ορισμός της εντροπίας
Η εντροπία ενός θερμοδυναμικού συστήματος ορίζεται ως ο φυσικός λογάριθμος του αριθμού των διαφορετικών μικροκαταστάσεων , που αντιστοιχεί σε μια δεδομένη μακροσκοπική κατάσταση (για παράδειγμα, μια κατάσταση με μια δεδομένη συνολική ενέργεια).
Συντελεστής αναλογικότητας και είναι η σταθερά του Boltzmann. Αυτή είναι μια έκφραση που ορίζει τη σχέση μεταξύ μικροσκοπικής ( ) και μακροσκοπικές καταστάσεις ( ), εκφράζει την κεντρική ιδέα της στατιστικής μηχανικής.
Προσδιορισμός υποτιθέμενης τιμής
Η XXIV Γενική Διάσκεψη για τα Βάρη και τα Μέτρα, που πραγματοποιήθηκε στις 17-21 Οκτωβρίου 2011, ενέκρινε ψήφισμα στο οποίο, ειδικότερα, προτάθηκε η μελλοντική αναθεώρηση του Διεθνούς Συστήματος Μονάδων να πραγματοποιηθεί με τέτοιο τρόπο ώστε να καθορίστε την τιμή της σταθεράς Boltzmann, μετά την οποία θα θεωρείται οριστική ακριβώς. Ως αποτέλεσμα, θα εκτελεστεί ακριβήςισότητα κ=1,380 6Χ 10 −23 J/K. Αυτή η υποτιθέμενη σταθεροποίηση συνδέεται με την επιθυμία να επαναπροσδιοριστεί η μονάδα θερμοδυναμικής θερμοκρασίας Κέλβιν, συνδέοντας την τιμή της με την τιμή της σταθεράς του Boltzmann.
δείτε επίσης
Γράψτε μια κριτική για το άρθρο "Η σταθερά του Boltzmann"
Σημειώσεις
| Αυτό είναι ένα προσχέδιο άρθρου για τη θερμοδυναμική και τη στατιστική φυσική. Μπορείτε να βοηθήσετε το έργο προσθέτοντας σε αυτό. |
Ένα απόσπασμα που χαρακτηρίζει την Constant του Boltzmann
– Μα τι σημαίνει αυτό; – είπε σκεφτική η Νατάσα.- Ω, δεν ξέρω πόσο εκπληκτικό είναι όλο αυτό! - είπε η Σόνια, σφίγγοντας το κεφάλι της.
Λίγα λεπτά αργότερα, ο πρίγκιπας Αντρέι τηλεφώνησε και η Νατάσα μπήκε να τον δει. και η Σόνια, βιώνοντας μια συγκίνηση και μια τρυφερότητα που σπάνια είχε βιώσει, παρέμεινε στο παράθυρο, συλλογιζόμενη την εξαιρετική φύση αυτού που είχε συμβεί.
Την ημέρα αυτή υπήρχε η ευκαιρία να στείλουν γράμματα στον στρατό και η Κοντέσα έγραψε ένα γράμμα στον γιο της.
«Σόνια», είπε η κόμισσα, σηκώνοντας το κεφάλι της από το γράμμα καθώς η ανιψιά της περνούσε από δίπλα της. – Σόνια, δεν θα γράψεις στη Νικολένκα; - είπε η κόμισσα με μια ήσυχη, τρεμάμενη φωνή, και στο βλέμμα των κουρασμένων ματιών της, κοιτάζοντας μέσα από τα γυαλιά, η Σόνια διάβασε όλα όσα κατάλαβε η κόμισσα με αυτά τα λόγια. Αυτό το βλέμμα εξέφραζε ικεσία, φόβο άρνησης, ντροπή που έπρεπε να ρωτήσω και ετοιμότητα για ασυμβίβαστο μίσος σε περίπτωση άρνησης.
Η Σόνια πήγε στην κόμισσα και, γονατισμένη, της φίλησε το χέρι.
«Θα γράψω, μαμά», είπε.
Η Sonya μαλάκωσε, ενθουσιάστηκε και συγκινήθηκε από όλα όσα συνέβησαν εκείνη την ημέρα, ειδικά από τη μυστηριώδη παράσταση της μάντισσας που μόλις είδε. Τώρα που ήξερε ότι με την ευκαιρία της ανανέωσης της σχέσης της Νατάσα με τον Πρίγκιπα Αντρέι, ο Νικολάι δεν μπορούσε να παντρευτεί την πριγκίπισσα Μαρία, ένιωσε με χαρά την επιστροφή αυτής της διάθεσης αυτοθυσίας στην οποία αγαπούσε και είχε συνηθίσει να ζει. Και με δάκρυα στα μάτια και με τη χαρά της συνειδητοποίησης μιας γενναιόδωρης πράξης, διακόπηκε πολλές φορές από δάκρυα που θόλωσαν τα βελούδινα μαύρα μάτια της, έγραψε αυτό το συγκινητικό γράμμα, η λήψη του οποίου εξέπληξε τόσο τον Νικολάι.
Στο φρουραρχείο όπου οδηγήθηκε ο Pierre, ο αξιωματικός και οι στρατιώτες που τον πήραν τον αντιμετώπισαν με εχθρότητα, αλλά ταυτόχρονα με σεβασμό. Στη στάση τους απέναντί του μπορούσε κανείς ακόμα να αισθάνεται αμφιβολία για το ποιος ήταν (αν ήταν πολύ σημαντικό άτομο) και εχθρότητα λόγω της φρέσκιας ακόμη προσωπικής τους μάχης μαζί του.
Αλλά όταν, το πρωί μιας άλλης μέρας, ήρθε η βάρδια, ο Pierre ένιωσε ότι για τη νέα φρουρά - για τους αξιωματικούς και τους στρατιώτες - δεν είχε πλέον τη σημασία που είχε για αυτούς που τον πήραν. Και πράγματι, σε αυτόν τον μεγαλόσωμο, χοντρό άντρα στο καφτάνι ενός χωρικού, οι φρουροί της επόμενης μέρας δεν έβλεπαν πια εκείνον τον ζωντανό άνθρωπο που τόσο απελπισμένα πολέμησε με τον επιδρομέα και με τους στρατιώτες συνοδείας και είπε μια επίσημη φράση για τη διάσωση του παιδιού, αλλά είδε μόνο ο δέκατος έβδομος από αυτούς που κρατούνται για κάποιο λόγο, με εντολή των ανώτατων αρχών, οι αιχμάλωτοι Ρώσοι. Αν υπήρχε κάτι ιδιαίτερο για τον Πιερ, ήταν μόνο η δειλή, έντονα στοχαστική εμφάνισή του και η γαλλική γλώσσα, στην οποία, παραδόξως για τους Γάλλους, μιλούσε καλά. Παρά το γεγονός ότι την ίδια μέρα ο Πιερ συνδέθηκε με άλλους ύποπτους, καθώς το ξεχωριστό δωμάτιο που κατείχε χρειαζόταν ένας αξιωματικός.
Όλοι οι Ρώσοι που κρατήθηκαν με τον Πιέρ ήταν άνθρωποι της χαμηλότερης τάξης. Και όλοι αυτοί, αναγνωρίζοντας τον Πιερ ως κύριο, τον απέφευγαν, ειδικά από τη στιγμή που μιλούσε γαλλικά. Ο Πιερ άκουσε με λύπη τη γελοιοποίηση του εαυτού του.
Το επόμενο βράδυ, ο Pierre έμαθε ότι όλοι αυτοί οι κρατούμενοι (και πιθανότατα συμπεριλαμβανομένου του ίδιου) επρόκειτο να δικαστούν για εμπρησμό. Την τρίτη μέρα, ο Πιερ μεταφέρθηκε με άλλους σε ένα σπίτι όπου κάθονταν ένας Γάλλος στρατηγός με άσπρο μουστάκι, δύο συνταγματάρχες και άλλοι Γάλλοι με κασκόλ στα χέρια. Ο Pierre, μαζί με άλλους, τέθηκε σε ερωτήσεις σχετικά με το ποιος ήταν με την ακρίβεια και τη βεβαιότητα με την οποία συνήθως αντιμετωπίζονται οι κατηγορούμενοι, υπερβαίνοντας υποτίθεται τις ανθρώπινες αδυναμίες. που ήταν; Για ποιον σκοπό? και ούτω καθεξής.
Αυτές οι ερωτήσεις, αφήνοντας κατά μέρος την ουσία του ζητήματος της ζωής και αποκλείοντας τη δυνατότητα αποκάλυψης αυτής της ουσίας, όπως όλες οι ερωτήσεις στα δικαστήρια, είχαν ως στόχο μόνο να δημιουργήσουν το αυλάκι κατά μήκος του οποίου οι δικαστές ήθελαν να ρέουν οι απαντήσεις του κατηγορουμένου και να τον οδηγήσουν σε ο επιθυμητός στόχος, δηλαδή η κατηγορία. Μόλις άρχισε να λέει κάτι που δεν ικανοποιούσε τον σκοπό της κατηγορίας, πήραν ένα αυλάκι, και το νερό μπορούσε να κυλήσει όπου ήθελε. Επιπλέον, ο Pierre βίωσε το ίδιο πράγμα που βιώνει ένας κατηγορούμενος σε όλα τα δικαστήρια: σύγχυση ως προς το γιατί του έγιναν όλες αυτές οι ερωτήσεις. Ένιωθε ότι αυτό το κόλπο της εισαγωγής ενός αυλακιού χρησιμοποιήθηκε μόνο από συγκατάβαση ή, σαν να λέγαμε, από ευγένεια. Ήξερε ότι ήταν στην εξουσία αυτών των ανθρώπων, ότι μόνο η εξουσία τον είχε φέρει εδώ, ότι μόνο η εξουσία τους έδινε το δικαίωμα να απαιτούν απαντήσεις σε ερωτήσεις, ότι ο μόνος σκοπός αυτής της συνάντησης ήταν να τον κατηγορήσουν. Και επομένως, αφού υπήρχε εξουσία και υπήρχε η επιθυμία να κατηγορηθεί, δεν χρειαζόταν το κόλπο των ερωτήσεων και της δίκης. Ήταν προφανές ότι όλες οι απαντήσεις έπρεπε να οδηγούν σε ενοχές. Όταν τον ρώτησαν τι έκανε όταν τον πήραν, ο Pierre απάντησε με κάποια τραγωδία ότι κουβαλούσε ένα παιδί στους γονείς του, qu"il avait sauve des flammes [τον οποίο έσωσε από τις φλόγες]. - Γιατί τσακώθηκε με τον επιδρομέα Ο Πιερ απάντησε, ότι υπερασπιζόταν μια γυναίκα, ότι η προστασία μιας προσβεβλημένης γυναίκας είναι καθήκον κάθε ανθρώπου, ότι... Τον σταμάτησαν: αυτό δεν πήγε στην ουσία. Γιατί ήταν στην αυλή ενός σπιτιού που καίγεται , που τον είδαν μάρτυρες; Απάντησε ότι θα πήγαινε να δει τι συμβαίνει στη Μόσχα. Τον σταμάτησαν ξανά: δεν τον ρώτησαν πού πήγαινε και γιατί ήταν κοντά στη φωτιά; Ποιος ήταν; Επανέλαβαν η πρώτη ερώτηση προς αυτόν, στην οποία είπε ότι δεν ήθελε να απαντήσει και πάλι απάντησε ότι δεν μπορούσε να το πει αυτό.
Οι αριθμοί στις παρενθέσεις υποδεικνύουν το τυπικό σφάλμα στα τελευταία ψηφία της τιμής της ποσότητας. Κατ 'αρχήν, η σταθερά του Boltzmann μπορεί να ληφθεί από τον ορισμό της απόλυτης θερμοκρασίας και άλλων φυσικών σταθερών (για να γίνει αυτό, πρέπει να είστε σε θέση να υπολογίσετε τη θερμοκρασία του τριπλού σημείου του νερού από τις πρώτες αρχές). Αλλά ο προσδιορισμός της σταθεράς Boltzmann χρησιμοποιώντας τις πρώτες αρχές είναι πολύ περίπλοκος και μη ρεαλιστικός με την τρέχουσα ανάπτυξη της γνώσης σε αυτόν τον τομέα.
Η σταθερά του Boltzmann είναι μια περιττή φυσική σταθερά εάν μετρήσετε τη θερμοκρασία σε μονάδες ενέργειας, κάτι που πολύ συχνά γίνεται στη φυσική. Στην πραγματικότητα, είναι μια σύνδεση μεταξύ μιας καλά καθορισμένης ποσότητας - ενέργειας και βαθμού, η έννοια της οποίας έχει αναπτυχθεί ιστορικά.
Ορισμός της εντροπίας
Η εντροπία ενός θερμοδυναμικού συστήματος ορίζεται ως ο φυσικός λογάριθμος του αριθμού των διαφορετικών μικροκαταστάσεων Z που αντιστοιχούν σε μια δεδομένη μακροσκοπική κατάσταση (για παράδειγμα, καταστάσεις με δεδομένη συνολική ενέργεια).
Συντελεστής αναλογικότητας κκαι είναι η σταθερά του Boltzmann. Αυτή η έκφραση, η οποία ορίζει τη σχέση μεταξύ των μικροσκοπικών (Z) και των μακροσκοπικών (S) χαρακτηριστικών, εκφράζει την κύρια (κεντρική) ιδέα της στατιστικής μηχανικής.