Rozmer Boltzmannovej konštanty. Ludwig Boltzmann: Osobné úspechy
Boltzmannova konštanta (k (\displaystyle k) alebo kB (\displaystyle k_(\rm (B)))) - fyzikálna konštanta, ktorá definuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej hrá táto konštanta kľúčovú úlohu. Jeho hodnota v Medzinárodnej sústave jednotiek SI podľa zmien v definíciách základných jednotiek SI (2018) sa presne rovná
k = 1 380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\krát 10^(-23)) J/.Vzťah medzi teplotou a energiou
V homogénnom ideálnom plyne pri absolútnej teplote T (\displaystyle T), energia na každý translačný stupeň voľnosti je rovnaká, ako vyplýva z Maxwellovho rozdelenia, k T / 2 (\displaystyle kT/2). Pri izbovej teplote (300 ) je táto energia 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J alebo 0,013 eV. V monatomickom ideálnom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu 3 2 kT (\displaystyle (\frac (3)(2))kT).
Keď poznáme tepelnú energiu, môžeme vypočítať strednú odmocninu rýchlosti atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmotnosti. Stredná kvadratická rýchlosť pri izbovej teplote sa pohybuje od 1370 m/s pre hélium do 240 m/s pre xenón. V prípade molekulového plynu sa situácia komplikuje, napríklad dvojatómový plyn má 5 stupňov voľnosti - 3 translačné a 2 rotačné (pri nízkych teplotách, keď nie sú excitované vibrácie atómov v molekule a ďalšie stupne voľnosti). sloboda sa nepridáva).
Definícia entropie
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov Z (\displaystyle Z), zodpovedajúce danému makroskopickému stavu (napríklad stavu s danou celkovou energiou).
S = klnZ. (\displaystyle S=k\ln Z.)Faktor proporcionality k (\displaystyle k) a je Boltzmannovou konštantou. Toto je výraz, ktorý definuje vzťah medzi mikroskopickými ( Z (\displaystyle Z)) a makroskopické stavy ( S (\displaystyle S)), vyjadruje ústrednú myšlienku štatistickej mechaniky.
Definujúci vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej hrá táto konštanta kľúčovú úlohu. Jeho experimentálna hodnota v medzinárodnom systéme jednotiek (SI) je:
J/.Čísla v zátvorkách označujú štandardnú chybu v posledných čísliciach hodnoty množstva. Boltzmannovu konštantu možno získať z definície absolútnej teploty a iných fyzikálnych konštánt. Výpočet Boltzmannovej konštanty pomocou prvých princípov je však príliš zložitý a pri súčasnom stave poznania nerealizovateľný. V prirodzenom systéme Planckových jednotiek je prirodzená jednotka teploty daná tak, že Boltzmannova konštanta sa rovná jednote.
Vzťah medzi teplotou a energiou
V homogénnom ideálnom plyne pri absolútnej teplote je energia na každý translačný stupeň voľnosti, ako vyplýva z Maxwellovho rozdelenia, . Pri izbovej teplote (300 °C) je táto energia J alebo 0,013 eV. V monatomickom ideálnom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu .
Keď poznáme tepelnú energiu, môžeme vypočítať strednú odmocninu rýchlosti atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmotnosti. Stredná kvadratická rýchlosť pri izbovej teplote sa pohybuje od 1370 m/s pre hélium do 240 m/s pre xenón. V prípade molekulárneho plynu sa situácia komplikuje, napríklad dvojatómový plyn má približne päť stupňov voľnosti.
Definícia entropie
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov zodpovedajúcich danému makroskopickému stavu (napríklad stavu s danou celkovou energiou).
Koeficient úmernosti je Boltzmannova konštanta. Tento výraz, ktorý definuje spojenie medzi mikroskopickými () a makroskopickými stavmi (), vyjadruje ústrednú myšlienku štatistickej mechaniky.
pozri tiež
Poznámky
Nadácia Wikimedia. 2010.
Pozrite sa, čo je „Boltzmannova konštanta“ v iných slovníkoch:
- (symbol k), pomer univerzálnej GAS konštanty k AVOGADRO ČÍSLU, rovný 1,381,10 23 joulov na stupeň Kelvina. Označuje vzťah medzi kinetickou energiou častice plynu (atómu alebo molekuly) a jej absolútnou teplotou.... ... Vedecko-technický encyklopedický slovník
Boltzmannova konštanta-- [A.S. Anglicko-ruský energetický slovník. 2006] Energetické témy všeobecne EN Boltzmannova konštanta ... Technická príručka prekladateľa
Boltzmannova konštanta- Boltzmannova konštanta Boltzmannova konštanta Fyzikálna konštanta, ktorá definuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej táto konštanta ... Výkladový anglicko-ruský slovník o nanotechnológii. - M.
Boltzmannova konštanta- Bolcmano konstanta statusas T sritis fizika atitikmenys: angl. Boltzmannov konštantný vok. Boltzmann Constante, f; Boltzmannsche Konstante, f rus. Boltzmannova konštanta, f pranc. Constante de Boltzmann, f … Fizikos terminų žodynas
Vzťah S k lnW medzi entropiou S a termodynamickou pravdepodobnosťou W (k Boltzmannova konštanta). Štatistická interpretácia druhého termodynamického zákona je založená na Boltzmannovom princípe: prírodné procesy majú tendenciu transformovať termodynamiku... ...
- (Maxwell Boltzmannovo rozdelenie) rovnovážne rozdelenie častíc ideálneho plynu energiou (E) vo vonkajšom silovom poli (napríklad v gravitačnom poli); je určená distribučnou funkciou f e E/kT, kde E je súčet kinetických a potenciálnych energií... Veľký encyklopedický slovník
Nezamieňať s Boltzmannovou konštantou. Konštanta Stefana Boltzmanna (tiež Stefanova konštanta), fyzikálna konštanta, ktorá je konštantou úmernosti v zákone Stefana Boltzmanna: celková energia emitovaná na jednotku plochy... Wikipedia
Hodnota konštanty Rozmer 1,380 6504(24)×10−23 J K−1 8,617 343(15)×10−5 eV K−1 1,3807×10−16 erg K−1 Boltzmannova konštanta (k alebo kb) fyzikálna konštanta, ktorá definuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskej... ... Wikipédii
Štatisticky rovnovážna distribučná funkcia nad hybnosťou a súradnicami častíc ideálneho plynu, ktorého molekuly sa riadia klasickým mechanika, vo vonkajšom potenciálnom poli: Tu Boltzmannova konštanta (univerzálna konštanta), absolútna... ... Matematická encyklopédia
knihy
- Vesmír a fyzika bez „temnej energie“ (objavy, nápady, hypotézy). V 2 zväzkoch. Zväzok 1, O. G. Smirnov. Knihy sú venované problémom fyziky a astronómie, ktoré existujú vo vede desiatky a stovky rokov od G. Galilea, I. Newtona, A. Einsteina až po súčasnosť. Najmenšie častice hmoty a planét, hviezd a...
Podľa Stefan-Boltzmannovho zákona hustota integrálneho pologuľového žiarenia E 0 závisí iba od teploty a mení sa úmerne štvrtej mocnine absolútnej teploty T:
Stefanova-Boltzmannova konštanta σ 0 je fyzikálna konštanta zahrnutá v zákone, ktorá určuje objemovú hustotu rovnovážneho tepelného žiarenia absolútne čierneho telesa:

Historicky bol Stefan-Boltzmannov zákon formulovaný pred Planckovým radiačným zákonom, z ktorého ako dôsledok vyplýva. Planckov zákon stanovuje závislosť spektrálnej hustoty toku žiarenia E 0 na vlnovej dĺžke λ a teplote T:

kde λ – vlnová dĺžka, m; s=2,998 10 8 m/s – rýchlosť svetla vo vákuu; T– telesná teplota, K;
h= 6,625 × 10 -34 J × s – Planckova konštanta.
Fyzikálna konštanta k, rovná pomeru univerzálnej plynovej konštanty R=8314J/(kg×K) k Avogadrovmu číslu N.A.=6,022 × 1026 1/(kg × mol):

Počet rôznych konfigurácií systému od Nčastice pre danú množinu čísel n i(počet častíc v i-stav, ktorému zodpovedá energia e i) je úmerný hodnote:

Rozsah W existuje viacero spôsobov distribúcie Nčastice podľa energetických hladín. Ak je vzťah (6) pravdivý, potom sa predpokladá, že pôvodný systém sa riadi Boltzmannovou štatistikou. Sada čísel n i, pri ktorom je číslo W maximum, vyskytuje sa najčastejšie a zodpovedá najpravdepodobnejšiemu rozdeleniu.
Fyzikálna kinetika– mikroskopická teória procesov v štatisticky nerovnovážnych systémoch.
Opis veľkého počtu častíc možno úspešne uskutočniť pomocou pravdepodobnostných metód. Pre monatomický plyn je stav množiny molekúl určený ich súradnicami a hodnotami projekcií rýchlosti na zodpovedajúcich súradnicových osiach. Matematicky to popisuje distribučná funkcia, ktorá charakterizuje pravdepodobnosť, že častica bude v danom stave:

je očakávaný počet molekúl v objeme dd, ktorých súradnice sú v rozsahu od do +d a ktorých rýchlosti sú v rozsahu od do +d.
Ak možno zanedbať časovo spriemerovanú potenciálnu energiu interakcie molekúl v porovnaní s ich kinetickou energiou, potom sa plyn nazýva ideálny. Ideálny plyn sa nazýva Boltzmannov plyn, ak pomer dĺžky dráhy molekúl v tomto plyne k charakteristickej veľkosti toku L samozrejme, t.j.

pretože dĺžka dráhy je nepriamo úmerná nd 2(n je numerická hustota 1/m 3, d je priemer molekuly, m).
Veľkosť
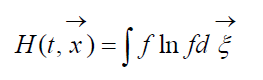
volal H-Boltzmannova funkcia pre jednotkový objem, ktorá je spojená s pravdepodobnosťou detekcie sústavy molekúl plynu v danom stave. Každý stav zodpovedá určitému počtu vyplnených šesťrozmerných buniek priestorovej rýchlosti, do ktorých možno rozdeliť fázový priestor uvažovaných molekúl. Označme W pravdepodobnosť, že v prvej bunke uvažovaného priestoru bude molekúl N 1, v druhej bunke N 2 atď.
Až do konštanty, ktorá určuje pôvod pravdepodobnosti, platí nasledujúci vzťah:
 ,
,
Kde 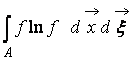 – H-funkcia oblasti priestoru A obsadené plynom. Z (9) je zrejmé, že W A H vzájomne prepojené, t.j. zmena pravdepodobnosti stavu vedie k zodpovedajúcemu vývoju funkcie H.
– H-funkcia oblasti priestoru A obsadené plynom. Z (9) je zrejmé, že W A H vzájomne prepojené, t.j. zmena pravdepodobnosti stavu vedie k zodpovedajúcemu vývoju funkcie H.

Boltzmannov princíp vytvára spojenie medzi entropiou S fyzikálny systém a termodynamická pravdepodobnosť W jej stavy:

(vydané podľa publikácie: Kogan M.N. Dynamics of a rarefied gas. - M.: Nauka, 1967.)
Celkový pohľad na CUBE:

kde je hmotnostná sila v dôsledku prítomnosti rôznych polí (gravitačných, elektrických, magnetických) pôsobiacich na molekulu; J– kolízny integrál. Práve tento člen Boltzmannovej rovnice berie do úvahy vzájomné zrážky molekúl a zodpovedajúce zmeny rýchlostí interagujúcich častíc. Kolízny integrál je päťrozmerný integrál a má nasledujúcu štruktúru:

Rovnica (12) s integrálom (13) bola získaná pre zrážky molekúl, pri ktorých nevznikajú tangenciálne sily, t.j. kolidujúce častice sa považujú za dokonale hladké.
Pri interakcii sa vnútorná energia molekúl nemení, t.j. predpokladá sa, že tieto molekuly sú dokonale elastické. Uvažujeme dve skupiny molekúl, ktoré majú rýchlosti a pred vzájomnou zrážkou (zrážkou) (obr. 1), a po zrážke, resp. Rozdiel v rýchlosti sa nazýva relatívna rýchlosť, t.j. . Je jasné, že pre hladkú elastickú zrážku . Distribučné funkcie f 1 ", f", f 1, f opisujú molekuly zodpovedajúcich skupín po a pred zrážkami, t.j. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Ryža. 1. Zrážka dvoch molekúl.
(13) zahŕňa dva parametre charakterizujúce umiestnenie kolidujúcich molekúl voči sebe navzájom: b a e; b– miera vzdialenosti, t.j. najmenšia vzdialenosť, na ktorú by sa molekuly priblížili v neprítomnosti interakcie (obr. 2); ε sa nazýva kolízny uhlový parameter (obr. 3). Integrácia ukončená b od 0 do ¥ a od 0 do 2p (dva externé integrály v (12)) pokrýva celú rovinu silovej interakcie kolmú na vektor

Ryža. 2. Trajektória pohybu molekúl.

Ryža. 3. Úvaha o interakcii molekúl vo valcovom súradnicovom systéme: z, b, ε
Boltzmannova kinetická rovnica je odvodená z nasledujúcich predpokladov a predpokladov.
1. Predpokladá sa, že dochádza najmä ku zrážkam dvoch molekúl, t.j. úloha zrážok troch alebo viacerých molekúl súčasne je nevýznamná. Tento predpoklad nám umožňuje použiť na analýzu jednočasticovú distribučnú funkciu, ktorá sa vyššie jednoducho nazýva distribučná funkcia. Zohľadnenie kolízie troch molekúl vedie k potrebe použiť v štúdii dvojčasticovú distribučnú funkciu. V dôsledku toho sa analýza výrazne skomplikuje.
2. Predpoklad molekulárneho chaosu. Vyjadruje sa v skutočnosti, že pravdepodobnosti detekcie častice 1 vo fázovom bode a častice 2 vo fázovom bode sú navzájom nezávislé.
3. Rovnako pravdepodobné sú zrážky molekúl s akoukoľvek dopadovou vzdialenosťou, t.j. distribučná funkcia sa pri interakčnom priemere nemení. Treba poznamenať, že analyzovaný prvok musí byť malý, aby f v rámci tohto prvku sa nemení, ale zároveň tak, aby relatívna fluktuácia ~ nebola veľká. Interakčné potenciály použité pri výpočte kolízneho integrálu sú sféricky symetrické, t.j. ![]() .
.
Maxwell-Boltzmannovo rozdelenie
Rovnovážny stav plynu je opísaný absolútnym Maxwellovým rozdelením, ktoré je presným riešením Boltzmannovej kinetickej rovnice:

kde m je hmotnosť molekuly, kg.
Všeobecná lokálna Maxwellova distribúcia, inak nazývaná Maxwell-Boltzmannova distribúcia:

v prípade, keď sa plyn pohybuje ako celok rýchlosťou a premenné n, T závisia od súradnice
a čas t.
V gravitačnom poli Zeme presné riešenie Boltzmannovej rovnice ukazuje:

Kde n 0 = hustota na povrchu Zeme, 1/m 3 ; g– tiažové zrýchlenie, m/s 2 ; h– výška, m Vzorec (16) je presným riešením Boltzmannovej kinetickej rovnice buď v neobmedzenom priestore, alebo za prítomnosti hraníc, ktoré toto rozdelenie neporušujú, pričom teplota musí tiež zostať konštantná.
Túto stránku navrhla Puzina Yu.Yu. s podporou Ruskej nadácie pre základný výskum - projekt č. 08-08-00638.
Boltzmannova konštanta ( alebo ) - fyzikálna konštanta, ktorá definuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej hrá táto konštanta kľúčovú úlohu. Jeho experimentálna hodnota v medzinárodnom systéme jednotiek (SI) je:
J/.
Čísla v zátvorkách označujú štandardnú chybu v posledných čísliciach hodnoty množstva. V prirodzenom systéme Planckových jednotiek je prirodzená jednotka teploty daná tak, že Boltzmannova konštanta sa rovná jednote.
Vzťah medzi teplotou a energiou
V homogénnom ideálnom plyne pri absolútnej teplote , energia na každý translačný stupeň voľnosti je rovnaká, ako vyplýva z Maxwellovho rozdelenia, . Pri izbovej teplote (300 ) je táto energia J alebo 0,013 eV. V monatomickom ideálnom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu .
Keď poznáme tepelnú energiu, môžeme vypočítať strednú odmocninu rýchlosti atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmotnosti. Stredná kvadratická rýchlosť pri izbovej teplote sa pohybuje od 1370 m/s pre hélium do 240 m/s pre xenón. V prípade molekulárneho plynu sa situácia komplikuje, napríklad dvojatómový plyn má päť stupňov voľnosti (pri nízkych teplotách, keď nie sú excitované vibrácie atómov v molekule).
Definícia entropie
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov , zodpovedajúce danému makroskopickému stavu (napríklad stavu s danou celkovou energiou).
Faktor proporcionality a je Boltzmannovou konštantou. Toto je výraz, ktorý definuje vzťah medzi mikroskopickými ( ) a makroskopické stavy ( ), vyjadruje ústrednú myšlienku štatistickej mechaniky.
Fixácia predpokladanej hodnoty
XXIV. generálna konferencia pre váhy a miery, ktorá sa konala v dňoch 17. – 21. októbra 2011, prijala uznesenie, v ktorom sa najmä navrhuje, aby budúca revízia Medzinárodnej sústavy jednotiek prebiehala tak, aby fixovať hodnotu Boltzmannovej konštanty, po ktorej sa bude považovať za definitívnu presne tak. V dôsledku toho bude vykonaná presné rovnosť k=1,380 6X 10-23 J/K. Táto údajná fixácia je spojená s túžbou predefinovať jednotku termodynamickej teploty kelvin, spájajúc jej hodnotu s hodnotou Boltzmannovej konštanty.
pozri tiež
Napíšte recenziu na článok "Boltzmannova konštanta"
Poznámky
| Toto je návrh článku o termodynamike a štatistickej fyzike. Môžete pomôcť projektu jeho pridaním. |
Úryvok charakterizujúci Boltzmannovu konštantu
- Ale čo to znamená? - povedala Natasha zamyslene.- Ach, neviem, aké je to všetko výnimočné! - povedala Sonya a chytila sa za hlavu.
O niekoľko minút neskôr zavolal princ Andrej a prišla ho navštíviť Nataša; a Sonya, prežívajúca emócie a nehu, aké len zriedka zažila, zostala pri okne a premýšľala o mimoriadnej povahe toho, čo sa stalo.
V tento deň bola príležitosť poslať listy armáde a grófka napísala list svojmu synovi.
„Sonya,“ povedala grófka a zdvihla hlavu od listu, keď okolo nej prechádzala jej neter. – Sonya, nenapíšeš Nikolenke? - povedala grófka tichým, chvejúcim sa hlasom a v pohľade svojich unavených očí, pozerajúc cez okuliare, Sonya prečítala všetko, čo grófka v týchto slovách pochopila. Tento pohľad vyjadroval prosbu, strach z odmietnutia, hanbu za to, že sa musí pýtať, a pripravenosť na nezmieriteľnú nenávisť v prípade odmietnutia.
Sonya podišla ku grófke, pokľakla a pobozkala jej ruku.
"Napíšem, maman," povedala.
Sonya bola obmäkčená, vzrušená a dojatá všetkým, čo sa v ten deň stalo, najmä tajomným predstavením veštenia, ktoré práve videla. Teraz, keď vedela, že pri príležitosti obnovenia Natašinho vzťahu s princom Andrejom sa Nikolai nemohol oženiť s princeznou Maryou, radostne pocítila návrat tej nálady sebaobetovania, v ktorej milovala a bola zvyknutá žiť. A so slzami v očiach a s radosťou z uskutočnenia veľkorysého činu, niekoľkokrát prerušená slzami, ktoré zahalili jej zamatovo čierne oči, napísala ten dojemný list, ktorého prijatie Nikolaja tak ohromilo.
V strážnici, kde bol Pierre odvezený, sa k nemu dôstojník a vojaci, ktorí ho vzali, správali nepriateľsky, ale zároveň s rešpektom. V ich postoji k nemu bolo stále cítiť pochybnosti o tom, kto je (či je to veľmi dôležitá osoba), a nepriateľstvo kvôli ich ešte čerstvému osobnému zápasu s ním.
Ale keď ráno iného dňa prišla zmena, Pierre cítil, že pre nového strážcu - pre dôstojníkov a vojakov - to už nemá taký význam, aký to malo pre tých, ktorí ho vzali. A skutočne, v tomto veľkom, tučnom mužovi v roľníckom kaftane už strážcovia nasledujúceho dňa nevideli toho živého muža, ktorý tak zúfalo bojoval s nájazdníkom a sprievodnými vojakmi a povedal slávnostnú frázu o záchrane dieťaťa, ale videli iba sedemnásty z tých, ktorí boli z nejakého dôvodu zadržaní, na príkaz najvyšších orgánov, zajatí Rusi. Ak bolo na Pierrovi niečo zvláštne, bol to len jeho nesmelý, sústredene namyslený vzhľad a francúzsky jazyk, v ktorom, napodiv pre Francúzov, hovoril dobre. Napriek tomu, že v ten istý deň bol Pierre spojený s ďalšími podozrivými, pretože oddelenú miestnosť, ktorú obýval, potreboval dôstojník.
Všetci Rusi, ktorých držali s Pierrom, boli ľudia najnižšej hodnosti. A všetci, ktorí poznali Pierra ako majstra, sa mu vyhýbali, najmä preto, že hovoril po francúzsky. Pierre so smútkom počul výsmech seba samého.
Nasledujúci večer sa Pierre dozvedel, že všetci títo väzni (a pravdepodobne aj on sám) mali byť súdení za podpaľačstvo. Na tretí deň bol Pierre odvedený s ostatnými do domu, kde sedel francúzsky generál s bielymi fúzmi, dvaja plukovníci a ďalší Francúzi so šatkami na rukách. Pierre spolu s ďalšími dostal otázky o tom, kto je, s presnosťou a istotou, s akou sa zvyčajne zaobchádza s obžalovanými, údajne presahujúcou ľudské slabosti. kde bol? za akým účelom? a tak ďalej.
Tieto otázky, ponechajúc bokom podstatu životnej záležitosti a vylučujúce možnosť odhaliť túto podstatu, ako všetky otázky kladené na súdoch, mali za cieľ len vytvoriť ryhu, ktorou sudcovia chceli, aby odpovede obžalovaného plynuli a priviedli ho k želaný cieľ, teda k obžalobe. Len čo začal hovoriť niečo, čo nespĺňalo účel obvinenia, vzali žliabok a voda si mohla tiecť, kam chcela. Pierre navyše zažil to isté, čo obžalovaný na všetkých súdoch: zmätený z toho, prečo sa všetky tieto otázky pýtali práve jeho. Mal pocit, že tento trik s vložením žliabku bol použitý len zo zhovievavosti alebo akoby zo slušnosti. Vedel, že je v moci týchto ľudí, že ho sem priviedla len moc, že len moc im dáva právo žiadať odpovede na otázky, že jediným cieľom tohto stretnutia je obviniť ho. A preto, keďže bola moc a túžba obviňovať, nebolo treba triku otázok a súdenia. Bolo zrejmé, že všetky odpovede musia viesť k pocitu viny. Na otázku, čo robil, keď ho vzali, odpovedal Pierre s tragédiou, že niesol k rodičom dieťa, qu'il avait sauve des flammes [ktorého zachránil pred plameňmi]. - Prečo sa pobil s nájazdníkom Pierre odpovedal, že bráni ženu, že chrániť urazenú ženu je povinnosťou každého človeka, že... Bol zastavený: toto nešlo k veci, prečo horel na dvore domu , kde ho videli svedkovia Odpovedal, že sa išiel pozrieť, čo sa deje v Moskve prvá otázka, na ktorú povedal, že nechce odpovedať, znova odpovedal, že to nemôže povedať.
Čísla v zátvorkách označujú štandardnú chybu v posledných čísliciach hodnoty množstva. Boltzmannovu konštantu možno v zásade získať z definície absolútnej teploty a iných fyzikálnych konštánt (na to je potrebné vedieť vypočítať teplotu trojného bodu vody z prvých princípov). Stanovenie Boltzmannovej konštanty pomocou prvých princípov je však pri súčasnom vývoji poznatkov v tejto oblasti príliš zložité a nereálne.
Boltzmannova konštanta je redundantná fyzikálna konštanta, ak meriate teplotu v jednotkách energie, čo sa vo fyzike veľmi často robí. Je to vlastne spojenie medzi presne definovanou veličinou – energiou a stupňom, ktorej význam sa historicky vyvíjal.
Definícia entropie
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov Z zodpovedajúcich danému makroskopickému stavu (napríklad stavy s danou celkovou energiou).
Faktor proporcionality k a je Boltzmannovou konštantou. Tento výraz, ktorý definuje vzťah medzi mikroskopickými (Z) a makroskopickými (S) charakteristikami, vyjadruje hlavnú (centrálnu) myšlienku štatistickej mechaniky.